|

04 Enero 2016
del Sitio Web
PYHS
traducción de Pedro
Donaire
05 Enero 2016
del Sitio Web
BitNavegante
Versión original en ingles
P22-Hyd
Los científicos de la Universidad de Indiana han creado un
biomaterial altamente eficiente, capaz de catalizar la formación de
hidrógeno de ese "santo grial" de la división del H2O,
a fin de producir hidrógeno y oxígeno que sirva de combustible a
coches baratos y eficientes que funcionen con agua.
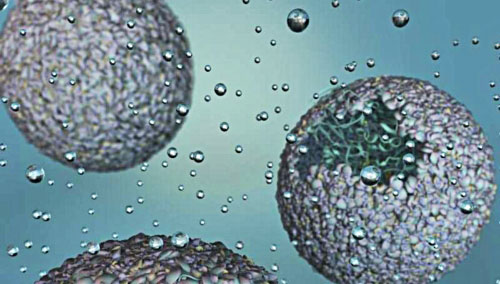
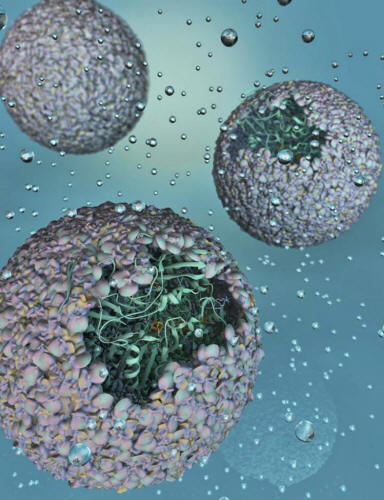
Renderización artística de P22-Hyd,
un nuevo biomaterial
creado al encapsular
una enzima de
hidrógeno dentro de una envoltura de virus.
Crédito: Indiana
University
La enzima modificada gana fuerza al estar protegida dentro de la
envoltura de proteínas o "cápside"
de un virus bacteriófago; este nuevo material es 150
veces más eficiente que la forma inalterada de la enzima.
El proceso de creación del material fue informado recientemente
en el journal Nature Chemistry.
"Básicamente, hemos tomado la
capacidad de un virus para auto-ensamblar innumerables bloques
de construcción genéticos e incorporarlos a una enzima muy
frágil y sensible, con la notable propiedad de tomar protones y
expulsar gas de hidrógeno", dijo Trevor Douglas, profesor de
Química Earl Blough en la Universidad de Artes y Ciencias de
Bloomington, que dirigió el estudio.
"El resultado final es una partícula
similar a un virus que se comporta igual que un material
altamente sofisticado que cataliza la producción de hidrógeno."
Otros científicos de la misma
universidad que han contribuido a la investigación fueron,
-
Megan C. Thielges, profesor
asistente de química
-
Ethan J. Edwards, Ph.D.
estudiante
-
Paul C. Jordan, un investigador
post-doctoral en Alios BioPharma, que era doctorando en el
momento del estudio
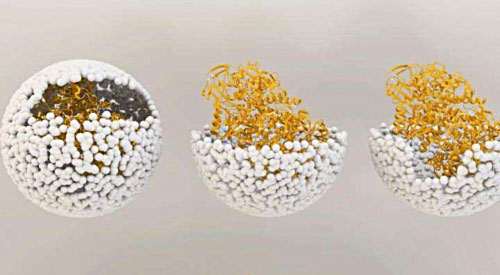
Ilustración que
muestra la liberación de hidrogenasa-NiFe
desde el interior de
la envoltura del virus, o "cápside",
de un P22
bacteriófago.
Crédito: Universidad
de Indiana
El material genético utilizado para
crear la enzima,
hidrogenasa, es producido por dos
genes de la bacteria común
Escherichia coli, insertados dentro
de la cápside de protección, utilizando métodos desarrollados
previamente por estos científicos.
Los genes, hyaA y hyaB, dos genes de la
E. coli que codifican subunidades clave de la enzima hidrogenasa. La
cápside proviene del virus bacteriano conocido como bacteriófago
P22.
El biomaterial resultante, llamado "P22-Hyd" (un nuevo
biomaterial creado mediante la encapsulación de una enzima
productora de hidrógeno dentro de un cascaron de virus), no sólo
es más eficiente que la enzima inalterada, sino que también se puede
producir a través de un proceso de fermentación sencilla a
temperatura ambiente.
El material es potencialmente mucho menos costoso de producir y más
respetuoso con el medio ambiente que otros materiales utilizados
actualmente para crear pilas de combustible.
Por ejemplo, el platino es un metal poco
frecuente y costoso, y se utiliza comúnmente para catalizar el
hidrógeno como combustible en productos tales como coches de
concepto de alta gama.
"Este material es comparable al
platino, excepto que es verdaderamente renovable", subrayó
Douglas.
"No es necesario extraerlo, puedes
crearlo a temperatura ambiente utilizando una tecnología de
fermentación a escala masiva, y es biodegradable. Se trata de un
proceso muy ecológico de fabricar un material sostenible de muy
alto nivel."
El P22-Hyd rompe los enlaces químicos
del agua para crear hidrógeno y además trabaja a la inversa para
recombinar el hidrógeno y el oxígeno para generar energía.
"La reacción se ejecuta en ambos
sentidos, de manera que puede ser utilizado como catalizador
para la producción de hidrógeno y como catalizador para pilas de
combustible", explicaba Douglas.
La forma de hidrogenasa es una de las
tres que se dan en la naturaleza:
di-hierro (FeFe), de sólo hierro
(Fe-only) y de nitrógeno-hierro (NiFe).
Para el nuevo material fue seleccionada
la tercera forma, debido a su capacidad para integrarse fácilmente
en los biomateriales y tolerar la exposición al oxígeno.
La
hidrogenasa-NiFe también gana
significativamente mayor resistencia a la encapsulación y
descomposición de productos químicos del medio ambiente, y conserva
la capacidad de catalizar a temperatura ambiente.
La hidrogenasa-NiFe sin alterar, por el
contrario, es altamente susceptible a la destrucción de productos
químicos del medio ambiente y se descompone a temperaturas
superiores a la temperatura ambiente, haciendo de esta enzima sin
protección una mala elección para su uso en la fabricación y
productos comerciales como los automóviles.
Estas sensibilidades son,
"algunas de las principales razones
por lo que estas enzimas no han cumplido anteriormente con su
promesa tecnológica", señaló Douglas.
Otra es su dificultad de producirla.
"Nadie logró nunca una forma de
crear la suficiente gran cantidad de esta hidrogenasa, pese a su
increíble potencial para la producción de biocombustibles.
Ahora, sin embargo, tenemos un
método para estabilizar y producir altas cantidades de material
y de aumentar enormemente su eficiencia."
El desarrollo es altamente
significativo, de acuerdo con Seung-Wuk Lee, profesor de
bioingeniería de la Universidad de California-Berkeley, que no formó
parte del estudio.
"El grupo de Douglas ha estado al
frente en este tipo de trabajos durante las dos últimas décadas.
Se trata de un nuevo trabajo pionero
para producir combustibles ecológicos y limpios y hacer frente
al problema de la energía en el mundo real al que nos
enfrentamos hoy en día, y crear con ello un impacto inmediato en
nuestra vida en el futuro cercano", comentó Lee, cuyo trabajo ha
sido citado en un informe del Congreso estadounidense sobre el
uso de los virus en la fabricación.
Más allá del nuevo estudio, Trevor
Douglas y sus colegas siguen trabajando con P22-Hyd como
ingrediente ideal para aprovechar la energía de hidrógeno
investigando formas de activar una reacción catalítica con la luz
del Sol, en contraposición a otros métodos de laboratorio.
"La incorporación de este material
en un sistema de energía solar es el siguiente paso", añadió
Douglas.
Referencias
|