|
Este capítulo trata del período de la historia de la Tierra en que organismos vivos suficientemente grandes para ser observados a simple vista crecieron y se movieron en los continentes y en el mar.
Los microorganismos todavía florecían y todavía eran responsables de una parte importante de la regulación de la Tierra. Sin embargo, la llegada de grandes comunidades de células de cuerpo blando alteró la superficie de la Tierra y el ritmo de la vida en ella: plantas que podían permanecer de pie sostenidas por estructuras de raíces profundas en el suelo, consumidores que podían trasladarse por el suelo y también por el aire o el mar.
Todos estos seres dejaron
restos fósiles. Su presencia marca el período denominado Fanerozoico,
que abarca desde el Cámbrico, hace unos 600 millones de años, hasta
la época actual. Debido a que vivimos en él, y debido a que los
registros históricos recientes son mucho más detallados que los del
pasado antiguo, parece que se trata de un período familiar y bien
conocido. Esto es una ilusión. Sabemos poco de la historia de la
Tierra, incluso de la de nuestra propia época. Desde el Cámbrico
sólo disponemos de catálogos de especies y rocas. Dan alguna
información acerca de la vida en la Tierra pero sólo de manera
sucinta, así como una guía de teléfonos informa acerca de las vidas
privadas y la economía de una ciudad.
De
manera semejante, la geofisiología, que está interesada en la Tierra
en su conjunto, no necesita abrumarse con masas de detalles, como
capas gruesas de hojas caídas, entre las ramas del árbol de la
ciencia. Echemos un vistazo por tanto a la fisiología de Gaia
durante este período. En una historia ideal se debería describir el
sistema al completo, pero el hábito de la reducción cala hondo. En
el presente estado de ignorancia es mejor dividir el capítulo en
secciones, cada una de ellas dedicada principalmente a la regulación
de un elemento químico importante y del clima.
En la atmósfera sólo hay
reserva de dióxido de carbono para unos pocos años. La desaparición
de los consumidores de la escena sería desastrosa para las plantas,
y en un intervalo de tiempo muy pequeño. No sólo se acabaría el
dióxido de carbono para la fotosíntesis, sino que habría cambios
climáticos muy importantes a medida que los gases de la atmósfera y
el albedo respondiesen a la muerte de las plantas. No menos
importante, el intrincado reciclado de nutrientes y la regeneración
del suelo desaparecerían. A escala humana, la coexistencia de
consumidores y productores se puede comparar con el largo período de
paz que ha reinado entre las superpotencias, hostiles pero
mutuamente interdependientes.
Ello es especialmente cierto durante la natación, en que se necesita una gran cantidad de energía. Todavía hoy, con un 21 por ciento de oxígeno en la atmósfera, nuestros músculos no pueden ser alimentados con suficiente oxígeno en condiciones de máximo esfuerzo. Una fuente de energía de reserva, denominada glicolisis, opera cuando corremos lo más rápidamente que podemos.
Peter Hochachka, en un curioso libro llamado “Living Without Oxygen” [Vivir sin oxígeno], describe los mecanismos intrincados mediante los que los animales afrontan la producción de energía en un mundo en que para ellos ésta se encuentra limitada por el suministro de oxígeno. Un ejemplo del efecto del tamaño se encuentra en relación con el monóxido de carbono. Para los animales tan grandes como nosotros es fatal. Mata impidiendo que los glóbulos rojos de la sangre puedan transportar oxígeno a nuestros tejidos.
Un animal pequeño, el ratón, puede
sobrevivir a la saturación completa de su sangre con monóxido de
carbono. Sobrevive porque una cantidad suficiente de oxígeno puede
difundirse a través de su piel y la superficie de sus pulmones.
Una sustancia como el radical hidroxilo es un oxidante tan superpotente que si se encontrase en la atmósfera en la misma concentración que el oxígeno cualquier cosa inflamable se quemaría instantáneamente. Reacciona con el metano a temperatura ambiente, mientras que el oxígeno no reacciona más que cerca de los 600 °C. Otros productos indeseables derivados del oxígeno son el peróxido de hidrógeno, el ión superóxido, y los átomos aislados de oxígeno. Las células vivas han desarrollado mecanismos para desintoxicarse de todos estos productos: enzimas, como la catalasa, que descompone el peróxido de hidrógeno en oxígeno y agua, y la superóxido dismutasa, que convierte el maligno ión superóxido en productos inofensivos.
Asimismo, antioxidantes, como
el tocoferol, eliminan los radicales hidroxilo. Nosotros y los demás
animales vivientes de hoy en día, desde el más grande al más
pequeño, debemos nuestra supervivencia a este sistema de protección
química desarrollado por nuestros antecesores bacterianos. Si no hay
un gran exceso de oxígeno se puede contener la toxicidad de estos
productos.
Al final del Arcaico, el aporte de especies químicas reductoras --sulfuros e ión ferroso- de la Tierra primitiva fue insuficiente para compensar el flujo de oxígeno proveniente de la deposición de carbono, y el oxígeno aumentó. En el Proterozoico temprano se llegó a un estado estacionario a baja concentración, mucho menor que la de la atmósfera presente. Este nivel provenía de un balance entre las necesidades de los consumidores y la toxicidad del oxígeno para los fotosintetizadores primitivos. No existe una transición tan claramente definida en el Proterozoico como la que corresponde a la aparición del oxígeno hacia el final del Arcaico (ver tabla 6.1).
No sabemos por qué empezó a subir de nuevo el nivel de oxígeno, aunque Robert Garrels propone que ello se encuentra asociado con el desarrollo de bacterias que reducen el sulfato. Ello hubiera dado lugar a la deposición de una parte mayor de los materiales producidos por los fotosintetizadores en forma de azufre o sulfuros, dejando detrás un exceso de oxígeno en el aire.
Ocurriera lo que ocurriera, las reacciones de este oxígeno libre con otros elementos tales como el carbono y el azufre liberarían ácidos a la atmósfera, lo que aumentaría la erosión de las rocas de la corteza y, consiguientemente, liberaría más nutrientes, lo que daría lugar a una mayor abundancia de organismos vivientes. Esta retroalimentación positiva sobre el aumento de oxígeno continuaría hasta que las desventajas de su presencia superasen a los efectos beneficiosos.
De manera semejante la población de coches en algunas ciudades crece hasta que el movimiento resulta restringido por su presencia.
En algún momento de este período los organismos empezaron a sintetizar a gran escala los precursores de esas sustancias misteriosas llamadas ligninas y ácidos húmicos. Estas pueden provenir de la invención de algunos antioxidantes nuevos. Los precursores de las ligninas son los fenoles, que son bien conocidos por su rápida reacción con los radicales hidroxilo.
Un ejemplo
típico de este tipo de sustancias es el coniferol, que cuando
reacciona con hidroxilo produce lignina, un polímero carbonoso que
tiene una gran estabilidad química y resistencia a la
biodegradación. Debido a estas propiedades la lignina daría lugar a
un incremento de la tasa de acumulación de carbono si se sintetiza
en grandes cantidades, y con ello también aumentaría la tasa de
producción de oxígeno.
Ambos materiales permiten la construcción de
grandes comunidades celulares de una nueva clase. A1 principio en
los océanos, y ahora en todos los organismos vivientes, las
identificamos como plantas y animales. El modelo de la evolución del
oxígeno y la regulación del dióxido de carbono representado en la
figura 5.4 puede extrapolarse hasta el período actual. Sin embargo
este modelo, tal como ha sido descrito, no permite explicar de
manera detallada la regulación precisa de la concentración de
oxígeno observada durante los últimos centenares de millones de
años.
Estos indican límites muy definidos para la cantidad de oxígeno atmosférico. Mi colega Andrew Watson mostró que los incendios no pueden empezar, ni siquiera en zonas secas, cuando el oxígeno se encuentra por debajo del 15 por ciento. Por encima del 25 por ciento los incendios son tan intensos que incluso la madera húmeda de las selvas tropicales se quemaría en una conflagración espantosa. Por debajo del 15 por ciento no podría haber carbón vegetal, por encima del 25 por ciento no podría haber bosques.
El oxígeno se encuentra
en una concentración del 21 por ciento, cerca del punto medio entre
estos límites.
Por otra parte, la combustión es ineficaz. Cualquier fabricante de carbón vegetal nos dirá que el 70 por ciento del carbón de la madera puede quedar preservado en una combustión controlada. Por tanto, los incendios pueden dar lugar a la acumulación de mucho más carbono porque el carbón vegetal es totalmente resistente a la degradación microbiana.
Paradójicamente,
pues, los incendios pueden dar lugar a una mayor acumulación de
carbono a largo plazo. Esta hipótesis preliminar podría dar lugar a
que existiera un efecto de retroalimentación positivo para la
acumulación de oxígeno, pero éste pronto daría lugar a tal
devastación de las selvas que la producción de carbono caería hasta
el punto en que el oxígeno se encontraría cerca o por debajo del
nivel actual. Entonces se repetiría el ciclo. Ciertamente las capas
de carbón vegetal que se encuentran en los sedimentos sugieren la
existencia de incendios recurrentes, pero la proporción de carbono
acumulado que existe en forma de carbón vegetal es demasiado pequeña
como para justificar la existencia de este ciclo.
Además estos fuegos dejan poco carbón, la combustión es casi completa. La ecología del fuego es tan evolucionada que algunas especies de coníferas requieren el calor del fuego para liberar las semillas de las cápsulas que las contienen. La precisa regulación del fuego para dar lugar a un nivel de oxígeno tan conveniente como el 21 por ciento sugiere que en ello juegan un papel crucial partes importantes de las plantas, inflamables o no inflamables, que son las víctimas y los beneficiarios del proceso.
No es adecuado plantearse si estos
árboles que utilizan la ecología del fuego también producen menos
lignina que el resto de la vegetación. Si fuera así representarían
una fuente menor de carbono sedimentario y así servirían para
regular el oxígeno a un nivel en que se producirían incendios pero
no tan intensos como para producir más mal que bien.
Los intentos
dé descripción del papel de cada una de estas partes del sistema
están limitados por la inevitable utilización de la expresión
escrita pero son necesarios. Con esta idea en mente, y recordando
que la geofisiología del carbono y del oxígeno no pueden separarse,
contemplemos ahora el dióxido de carbono.
Venus tiene ahora 300.000 veces más e incluso Marte, cuyo dióxido de
carbono se encuentra en gran liarte congelado en la superficie,
tiene 20 veces más. James Walker y sus colegas intentaron explicar
el bajo contenido de dióxidos de carbono en la Tierra mediante
simples argumentos geoquímicos.
El
segundo, un incremento de la tasa de reacción del dióxido de carbono
con las rocas. Estos dos procesos actuando de manera conjunta
incrementarían la tasa de erosión de las rocas y así disminuiría el
dióxido de carbono. El efecto neto consistiría en una
retroalimentación negativa en el aumento de la temperatura en la
medida que aumentase el calor procedente del Sol. Por desgracia este
modelo plausible e imaginativo no podía explicar los hechos. El
dióxido de carbono predecido para la época presente sería 100 veces
superior al que en realidad es.
Continuamente apartan el dióxido de carbono del aire y lo conducen a
las partes profundas del suelo donde puede reaccionar con las
partículas de las rocas y ser eliminado. Consideremos un árbol.
Durante su vida deposita en sus raíces toneladas de carbono que
recoge del aire; una parte del dióxido de carbono escapa de nuevo a
la atmósfera debido a la respiración de las raíces, y cuando el
árbol muere el carbono de las raíces es oxidado por los
consumidores, devolviendo a la atmósfera el dióxido de carbono que
se encontraba en las profundidades del suelo.
Si la vida no estuviera
presente el dióxido de carbono de la atmósfera tendría que
interaccionar con el silicato cálcico de las rocas mediante procesos
inorgánicos lentos como la difusión. En estas condiciones, para
mantener en el suelo la cantidad de dióxido de carbono que ahora se
observa, la concentración de este gas tendría que ser mucho mayor,
quizá del orden del 3 por ciento. Esta es la razón por la cual el
modelo de Walker no funciona.
Hay una relación inversa entre la abundancia de dióxido de carbono y la abundancia de vegetación. Si asumimos que la salud de Gaia se mide por la abundancia de vida, los períodos de salud serán los de bajo nivel de dióxido de carbono. Durante el estado de salud habitual de Gaia, en el frío confortable de la glaciación, el dióxido de carbono se encuentra a sólo 180 partes por millón en volumen -peligrosamente cercano al límite inferior necesario para el crecimiento de las plantas.
Las modernas plantas C4 comprenden fundamentalmente las hierbas, aunque no todas, mientras que los árboles y las plantas de hoja grande usualmente utilizan el ciclo C3. Eventualmente, y probablemente pronto, estas plantas nuevas sustituirán a las anteriores y serán capaces de desarrollarse incluso a concentraciones más bajas de dióxido de carbono para compensar el calor creciente del Sol.
Sin embargo, ello será una
solución temporal, porque si asumimos que la situación actual se
mantendrá en el futuro, en un tiempo tan corto como dentro de 100
millones de años, el Sol se habrá calentado lo suficiente como para
que la concentración de dióxido de carbono en la atmósfera tenga que
ser nula para mantener la temperatura media actual. En breve se
explicará que hay otros mecanismos de enfriamiento que pueden
intervenir. También podría suceder que evolucionara un ecosistema
que se encontrase cómodo a una temperatura media de hasta 40 °C.
De acuerdo con el físico japonés
Shigeru Moriyama,
el análisis matemático de la periodicidad de la temperatura media en
la Tierra en el último millón de años es más coherente con una
oscilación inducida externamente que con una oscilación autónoma, o
una respuesta simple a los cambios de energía radiante del Sol.
A primera vista parecería que las capas de hielo dejarían menos sitio para la vida ya que cubrirían una buena parte de lo que es ahora, o lo era antes de que aparecieran los seres humanos, tierra forestal. Sin embargo, a medida que el agua entraba a formar parte de los glaciares terrestres, el nivel del mar habría bajado unos 100 metros, dejando expuestas al aire vastas áreas de suelo rico y fértil de las plataformas continentales.
Un vistazo al mapa
de las plataformas continentales muestra que una gran parte de la
nueva tierra se encontraría en los trópicos húmedos, como las zonas
actuales del sudeste de Asia. Ello habría representado un área
equivalente á la superficie del África actual, y habría podido
mantener selvas tropicales.
El sistema también sería
inestable desde un punto de vista biológico. En una situación
cercana al límite inferior del dióxido de carbono necesario para el
mantenimiento de la fotosíntesis habría una intensa presión
selectiva sobre las plantas emergentes para que pudieran vivir con
menos dióxido de carbono aún.
La lluvia ácida emitida por las algas marinas como resultado
del exceso de salinidad, o bien un fallo en la producción de
sulfuros volátiles por el biota marino, que podría dar lugar a una
disminución de plantas terrestres privándolas de un elemento
esencial, podría ser otro. Una disminución de la cubierta de nubes y
del albedo planetario es otro. Los ciclos de las edades de los
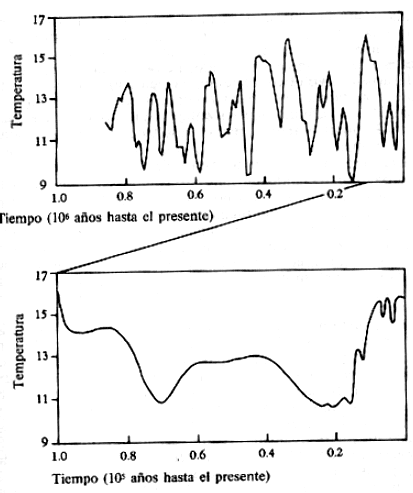
hielos son conocidos. En la figura 6.1 se muestra la historia de la
temperatura durante el último millón de años.
El último sol de invierno en latitudes continentales más allá de los 50 ° no es suficientemente potente para fundir nieve fresca, cuya blancura refleja la energía radiante hacia el cielo. Los pinos negros absorben la luz del Sol, calentándose no sólo los árboles sino también la zona. Una vez que la nieve se ha fundido incluso el suelo desnudo puede absorber luz solar, haciéndose suficientemente templado como para que germinen las semillas y permitiendo que comience la primavera.
¿Qué fue primero, el nivel bajo de dióxido de carbono y la cubierta de nubes densa o la baja temperatura?
Esta pregunta, como la de la prioridad del huevo o la gallina, carece seguramente de sentido. Pensemos en el caso de un desarrollo evolutivo reciente, la aparición de plantas C4 que son capaces de crecer a concentraciones más bajas de dióxido de carbono que las antiguas plantas C3.
Estas plantas C4 podrían representar el resultado de las glaciaciones y la inducción de más períodos glaciales. Ahora hay suficiente dióxido de carbono para todas las plantas por lo que no hay mucha competencia entre plantas C3 y C4 para ocupar los hábitats, excepto por lo que respecta a la intervención humana que, con finalidades agrícolas, elimina las plantas C3 primitivas y las reemplaza por trigo, arroz, bambú, caña de azúcar, etcétera, muchas de las cuales son plantas C4.
Durante una glaciación, cuando el dióxido de carbono está cerca
del límite tolerable para las plantas C3, las ventajas del
metabolismo C4 empiezan a desplazar la balanza a su favor.
Por desgracia su organismo encontró un alga unicelular
planctónica mucho más de su agrado que las plantas arroceras. Dicha
combinación tuvo tanto éxito que conquistó el mundo. Fue una
victoria pírrica porque el mundo binario de la combinación
alga-bacteria no pudo mantener la homeostasis planetaria por sí
mismo.
Bajo la sombra de los nuevos árboles volvió a desarrollarse el complejo ecosistema tropical. Pronto se vio que el problema del efecto invernadero asociado al dióxido de carbono desaparecería; el crecimiento lustroso de los árboles había incrementado tanto la tasa de absorción de dióxido de carbono por el suelo que el sumidero era ahora más grande que la fuente. Sin embargo, algunos científicos comentaron que la cubierta de nubes y por tanto el albedo habían aumentado.
Existía un debate científico
muy vivo: En línea con el pensamiento de moda, y animados por el
aporte generoso de fondos de investigación, los científicos
atribuían el incremento de la nubosidad a las actividades de la
industria química y nuclear.
Gaia volvió a respirar de nuevo, fría y acomodada a un contenido total de dióxido de carbono de 100 partes por millón. No mucho más tarde, en términos gaianos, los océanos comenzaron a retroceder en las vastas áreas de la plataforma continental: Australia, Papúa y Nueva Guinea estuvieron otra vez juntas de nuevo por tierra cubierta de una selva lujuriosa.
Las tierras y las
ciudades de las potencias de antaño fueron enterradas casi
completamente por los glaciares. Las plantas C4, con la ayuda de la
humanidad, se convirtieron en dominantes, y liberaron Gaia para el
inicio de otro largo período de homeostasis -una edad de hielo que
duraría millones de años, no únicamente centenares de miles.
Sin ningún tipo de retorno de azufre, los organismos terrestres pronto habrían agotado este elemento esencial. Allí conocí el trabajo realizado por el profesor Frederick Challenger de la Universidad de Leeds en los años cincuenta, mostrando que muchos organismos marinos emiten azufre en forma de un compuesto gaseoso, el sulfuro de dimetilo. También sabía, como químico, que el sulfuro de hidrógeno se oxida rápidamente en agua que contenga oxígeno disuelto, y que huele mal.
Con estos antecedentes me pareció que no
podía haber otra forma química más importante que el sulfuro de
dimetilo para el transporte de azufre del océano a la tierra. Por
otra parte, este olor elusivo del mar es muy parecido a una forma
diluida de sulfuro de dimetilo. Ciertamente, una vez que alguien ha
olido este gas, de olor agradable en concentraciones diluidas, se
puede reconocer incluso como un componente importante del aroma del
pescado fresco recién extraído del mar. Por el contrario no forma
parte del olor del pescado fresco de agua dulce.
Esta fue la última ocasión en que solicité fondos de investigación a través del sistema regular de escritura de un proyecto y remisión a una agencia de subvención científica. Solicité una cantidad pequeña, no más de unos pocos cientos de libras, para fabricar un aparato y llevarlo en el barco desde el hemisferio norte al sur, midiendo los gases cada día de navegación.
Lo tendría que haber sabido de antemano. Ambos
proyectos fueron rechazados. A los supervisores les pareció sin
sentido buscar sulfuro de dimetilo cuando era conocido que el flujo
de azufre perdido correspondía al transporte de sulfuro de
hidrógeno. El segundo proyecto, la búsqueda de halohidrocarburos,
fue rechazado por frívolo, porque era «obvio» que no existía ningún
aparato suficientemente sensible para medir las pocas partes por
trillón de clorofluorohidrocarburo que yo proponía buscar.
Algunos funcionarios amables del Consejo de Investigación para el Medio Ambiente Natural (Natural Environment Research Council), que discrepaban de la opinión del cuadro de asesores científicos, me pagaron los gastos de viaje y subsistencia a partir de un fondo discrecional. Viajé con un barco de investigación, el RV Schackleton, en su trayecto desde Gales a la Antártida y viceversa. Volví desde Montevideo, después de permanecer tres semanas en el barco - por desgracia éste era todo el tiempo que pude pagar - pero un colega científico, Roger Wade, continuó amablemente las medidas cuando el barco se encontraba en la Antártida.
Mi colega Robert Maggs voló a Montevideo en la primavera de 1972 para completar el viaje a casa a través del Ecuador hasta las islas Británicas. Las medidas realizadas en este viaje fueron dadas a conocer en tres pequeños trabajos publicados en la revista Nature. El primero describió las medidas de halohidrocarburos, mostrando que los clorofluorohidrocarburos erari compuestos persistentes y de larga vida en la atmósfera terrestre, y que otros dos gases halocarbonados, el tetracloruro de carbono y el ioduro de metilo, se encontraban por todas partes.
Estos descubrimientos dieron lugar, entre otras cosas, a la «guerra del ozono», y al desembolso de un océano de fondos de investigación, por recomendación de los mismos comités que habían rechazado las primeras solicitudes.
Las especulaciones acerca de la “amenaza al frágil escudo de la Tierra”, la capa de ozono, fueron más plausibles que la idea de un viaje de investigación estimulado por la mera curiosidad de un científico individual.
Los trabajos segundo y tercero sobre los gases sulfurosos mostraron la presencia ubicua de sulfuro de dimetilo y de sulfuro de carbono en los océanos.
Excepto en lo que respecta a los primeros cálculos
de los flujos de Peter Liss, de la Universidad de East Anglia, estos
resultados fueron ignorados durante mucho tiempo hasta que M.O.
Andreae mostró, mediante sus medidas cuidadosas y extensivas de los
gases sulfurados oceánicos a principios de los ochenta, que las
emisiones de sulfuro de dimetilo desde el océano eran ciertamente
suficientes como para justificar su papel como el mayor agente
transportador de azufre del mar a tierra.
Así, uno puede preguntarse,
No se conoce todavía la respuesta con detalle, pero tenemos un indicio de cómo puede haber evolucionado a partir de las propiedades de un extraño compuesto llamado propionato de dimetilsulfonio. Esta sustancia es lo que los químicos orgánicos llaman una betaína, a partir del descubrimiento hace muchos años de un compuesto similar, el acetato de trimetilamonio o betaína, que se aisló en primer lugar a partir de los escarabajos.
La importancia de las betaínas para la salud de los organismos que viven en ambientes salobres fue descubierta por A. Vairavamurthy y sus colegas.
Las betaínas son sales neutras. Transportan sobre la misma molécula una carga positiva, asociada con el azufre o nitrógeno, y una carga negativa, asociada con el ión propionato. En una sal ordinaria, tal como el cloruro sódico, la disolución en agua separa las partículas cargadas, que se convierten en iones independientes que flotan libremente.
Como vimos en el capítulo anterior, la vida marina vive
cerca del límite tolerable de concentración salina. Las
concentraciones de cloruro sódico por encima de 0,8 molar son
tóxicas, pero ello no es aplicable a las betaínas. La neutralización
interna de sus cargas iónicas las convierte en sales inocuas, y en
la célula se comportan como los azúcares, el glicerol y otros
solutos neutros. Las células que son capaces de sustituir una gran
proporción de sal por betaína se encuentran en una posición
ventajosa.
A su vez, la síntesis de las betaínas sería un proceso común entre las algas marinas. El azufre es muy abundante en el mar mientras que el nitrógeno a menudo es escaso. En tierra se encuentra la situación inversa. Ello puede ser la razón por la que el propionato de dimetilsulfonio fue la betaína escogida en lugar de las betaínas de nitrógeno de los escarabajos y otras plantas terrestres. (De manera incidental cabe señalar que los escarabajos también pueden existir en presencia de concentraciones elevadas de sal.)
Ello puede no proporcionar una explicación completa de la presencia de propionato de dimetilsulfonio como betaína predominante en las algas, pero no hay duda de que las algas que la contienen constituyen la fuente de sulfuro de dimetilo. Cuando las algas mueren o son ingeridas, la sulfobetaína se descompone fácilmente para dar lugar al ión acrilato y al sulfuro de dimetilo.
Las algas que tendieran a quedarse en las zonas superiores y secas de la playa darían por tanto lugar a este gas sulfuroso y las brisas provenientes del mar lo transportarían tierra adentro donde las reacciones atmosféricas lo descompondrían lentamente y depositarían el azufre como sulfato y metanosulfato en el suelo.
El azufre es escaso en tierra y esta fuente nueva podría haber propiciado el crecimiento de las plantas terrestres. Este crecimiento incrementado aumentaría la erosión de las rocas y así aumentaría el flujo de nutrientes hacia el océano. No es difícil explicar la extensión mutua de los ecosistemas terrestres a partir del aporte de azufre y de los ecosistemas marinos a partir del incremento del flujo de nutrientes. De este modo, o mediante una serie similar de pasos pequeños, evolucionan los intrincados sistemas de regulación geofisiológica.
Esto ocurre sin ninguna
planificación o previsión, y sin romper las reglas de la selección
natural darwniana.
La emisión de
ioduro de metilo a' aire desde el mar es un mecanismo esencial para
el mantenimiento de un aporte continuo de iodo hacia las masas
continentales, un elemento que es vital para los organismos
terrestres. Puede valer la pena investigar la posibilidad de que una betaína específica, el propionato de metiliodonio, exista en algas
grandes como las algas pardas, que son una fuente importante de
ioduro de metilo. Si es así, ello sugerirá una relación común con la
historia de la sulfobetaína.
Hay un conjunto de datos importantes que sugiere que las mayores erupciones volcánicas suelen ir acompañadas de una caída en la temperatura media de la superficie terrestre. Los gases volcánicos inyectados en la estratosfera por las erupciones comprenden dióxido de azufre y sulfuro de hidrógeno. (La nube volcánica también consiste en un aerosol de material sólido pero éste se deposita pronto.)
Los gases sulfurosos que quedan en la estratosfera se oxidan y con el vapor de agua allí presente forman gotas submicroscópicas de ácido sulfúrico. Debido a su pequeño tamaño éstas se depositan lentamente y pueden permanecer en la atmósfera durante varios años. Estas gotas forman una neblina blanca en la estratosfera que devuelve al espacio la luz del Sol que, en caso contrario, calentaría la Tierra. Entre erupción y erupción queda un fondo de gotas de ácido sulfúrico que se forman continuamente a partir de la oxidación de gases emitidos por los seres vivos. Los más importantes de ellos son el sulfuro de carbonilo y el sulfuro de carbono.
Estos corresponden a emisiones pequeñas en comparación con el sulfuro de dimetilo pero en la baja atmósfera son oxidados lentamente (el sulfuro de carbonilo de manera especialmente lenta) y permanecen el tiempo suficiente para entrar en la estratosfera y ser oxidados allí. El planteamiento de Glen Shaw consiste en que el sobrecalentamiento global puede ser compensado por la vida marina que, en consecuencia, incrementaría su emisión de sulfuro de carbonilo y sulfuro de carbono, lo que puede dar lugar a un mayor espesor de la capa de neblina de gotas de ácido sulfúrico de la estratosfera y, por tanto, a un enfriamiento de la Tierra.
Ciertamente éste puede ser uno de los mecanismos geofisiológicos posibles de regulación climática. Pero esta idea
incitó a mis colegas a pensar qué ocurriría con un uso mucho más
importante de los gases sulfurosos con la misma finalidad.
Este descubrimiento llevó a los meteorólogos R. Charlson y Stephen Warren a proponer que la oxidación rápida del sulfuro de dimetilo en el aire sobre el océano podría dar lugar a núcleos necesarios para la condensación de vapor de agua y la formación de nubes. Las microgotas de ácido sulfúrico son ideales para esta finalidad, y sobre los océanos abiertos no existe otra fuente importante de núcleos de condensación a partir de los que se puedan formar nubes.
El aerosol de sal marina, que también puede ser considerado un posible nucleador de nubes, es mucho menos eficaz que las microgotas de ácido sulfúrico. Los océanos cubren alrededor de dos tercios de la superficie de la Tierra y su color es azul oscuro. Cualquier cosa que afecte a la cubierta de nubes sobre los océanos puede afectar de forma importante al clima de la Tierra.
En una publicación conjunta,
hemos dado a conocer cálculos para estimar el efecto que pueden
tener estas emisiones de sulfuro de dimetilo naturales. Estos
sugieren que son comparables en magnitud con el efecto invernadero
del dióxido de carbono, aunque en sentido contrario a él.
La producción de ioduro de metilo por las algas también puede
constituir una parte de este sistema de control climático.
Casi se encuentran carentes de vida, como los grandes desiertos terrestres que se extienden a 30° de latitud norte y sur del ecuador. En tierra, lo que da lugar al desierto es la falta de agua; en el mar es la falta de nutrientes, fundamentalmente nitrógeno. ¿A qué se parecen estos océanos desérticos? Sus aguas son claras y azules y, como los desiertos terrestres, de ninguna manera la vida está ausente. Uno de estos desiertos es el mar de los Sargazos. Recuerdo que cuando era un muchacho leí una historia de aventuras acerca de los peligros afrontados por un velero atrapado en la densa maraña de algas del mar de los Sargazos.
Cuando pasé por esta región, en 1973,
a bordo del barco alemán Meteor, me sorprendió la diferencia entre
la realidad y mis recuerdos de esas historias. Había algas
flotantes, pero en tiras finas y bien separadas, y no representaban
un impedimento mayor al que correspondería a la artemisa cuando se
camina a través del suelo del desierto.
Aunque podría
haber sido un descubrimiento de las algas marinas que se desecaban
en la orilla, los inventos útiles tienden a extenderse.
El propionato de dimetilsulfonio permanece en las células de las algas durante toda su vida, pero cuando mueren o son ingeridas se dispersa en el océano donde se descompone para dar lugar a sulfuro de dimetilo. Este gas es oxidado rápidamente en el aire por los ubicuos radicales hidroxilo hasta que casi todo él se convierte en ácido sulfúrico y metanosulfúrico.
Los vapores de estos
ácidos son transportados junto con los movimientos del aire hasta
que alcanzan las alturas supersaturadas con vapor de agua, donde
actúan como núcleos de condensación de nubes.
Esta es una efectiva
recompensa por la producción de núcleos de condensación de nubes que
ha sido confirmada por el trabajo del meteorólogo John Woods.
De modo parecido las islas Hawai reciben polvo desde el continente asiático que se encuentra a más de 6.000 kilómetros de distancia. El contenido mineral de este polvo, cuando es arrastrado hacia el mar por la lluvia, también puede ser útil para la nutrición de las algas que se encuentran allí. La superficie de las partículas de polvo no es adecuada para que éstas sirvan como núcleos de condensación de lluvia, pero son arrastradas hacia el mar por la lluvia inducida por el sulfuro de dimetilo.
Finalmente, las nubes que se forman sobre el
océano filtran la radiación que llega a la superficie de las aguas y
reducen la proporción de radiación ultravioleta. La luz visible
necesaria para la fotosíntesis no es un factor limitante en estos
ecosistemas oceánicos pobres en nutrientes, por lo que el efecto de
sombra de las nubes es irrelevante.
La cuestión complicada es la siguiente: ¿De qué manera este sistema se ha convertido en factor de la regulación climática de la Tierra?
Los océanos se vuelven más salados cuando el agua se
congela en los casquetes polares, lo que puede dar lugar a un
incremento en la emisión de sulfuro de dimetilo, y de nubosidad, y
así a una retroalimentación positiva hacia más enfriamiento. Puede
ocurrir que la gran biomasa asociada con las glaciaciones
proporcione más nutrientes a la vida oceánica y así permita el
mantenimiento de más algas.
Sus datos muestran una correlación inversa muy marcada entre la temperatura global y la inclusión de estos ácidos en el hielo. El ácido sulfúrico tiene diferentes fuentes naturales, pero el ácido metanosulfónico es un producto inequívoco de la oxidación atmosférica del sulfura de dimetilo. Había de dos a cinco veces más deposición de esta sustancia durante la Edad de Hielo y parece probable que ello era debido a una mayor emisión de los ecosistemas oceánicos.
Esto sugiere, si se confirma, que la cubierta de nubes y la caída en la concentración de dióxido de carbono operarían en sincronía como parte de un proceso geofisiológico para mantener la Tierra fría. Los científicos más conservadores prefieren la explicación geofísica que se deriva de la teoría oceánica del científico W.S. Broecker, quien propuso que las glaciaciones se encuentran asociadas con cambios a gran escala en la circulación del agua de los océanos.
Ciertamente, el incremento en el aporte de nutrientes que acompañaría a un suceso semejante podría modificar la productividad biológica y por tanto la tasa de eliminación de dióxido de carbono y la producción de sulfuro de dimetilo. Parece que empieza un debate interesante.
Pienso que podría ser útil acabar esta sección con una descripción geofisiológica de la evolución del clima y de la composición química de la atmósfera (ver figura 6.3).
Esta consiste en una sucesión de largos períodos de homeostasis interrumpidos por grandes saltos. Parece ser que nos aproximamos al final de uno de estos largos períodos de estabilidad. Cuando la vida comenzó, el Sol era menos luminoso y la amenaza era el superenfriamiento.
En las edades medias del Proterozoico el Sol brillaba justo lo necesario y fue necesaria poca regulación, pero ahora que aumenta de tamaño y se hace más caliente, su emisión de calor aumenta y se convierte en una amenaza cada vez mayor para la biosfera de la que formamos parte.
|