|
En la época victoriana, el trasfondo familiar y social tenía una importancia equivalente a la que hoy se da en ciertos lugares al CI. En la actualidad, si alguien habla de pedigrí, lo más probable es que sea un granjero o un miembro de algún club de cría caballar o perruna.
Es ésta la época, sin embargo, en la que a la hora de conseguir trabajo tanta importancia tiene el nivel educacional, la titulación universitaria, el curriculum académico. Son éstos los factores que suelen determinar la elección de un candidato entre el conjunto de solicitantes; pocas veces se intenta averiguar la valía real, el potencial auténtico de cada uno.
Hasta hace pocos años, la mayoría de nosotros manteníamos una actitud igualmente tendenciosa cuando reflexionábamos sobre el planeta que habitamos, concentrando toda nuestra atención en su más remoto pasado. Se escribían y publicaban montañas de monografías, de artículos y de libros de texto sobre el registro geológico, sobre la vida en los océanos primigenios; estas miradas atrás parecían poder explicarnos cuanto necesitábamos saber sobre las características y el potencial de la Tierra.
El resultado,
tan bueno como seleccionar los aspirantes a un trabajo mediante el
estudio de los huesos de los abuelos respectivos.
Ocurriera lo que ocurriera en el pasado remoto, somos indudablemente una parte viva incluida en una anomalía extraña y bella de nuestro sistema solar. Nuestra atención se ha desplazado a la Tierra que ahora podemos estudiar desde el espacio, a las propiedades de su atmósfera en particular. Nuestros conocimientos sobre la composición y el comportamiento del tenue velo gaseoso que envuelve al planeta, cuyas capas más próximas a la superficie exhiben una curiosa mezcla de gases activos que, si bien en recombinación perpetua, nunca dejan de estar en equilibrio y cuyos jirones externos penetran miles de kilómetros en el espacio unidos a su anfitrión planetario por una atracción gravitatoria ya muy debilitada, nuestros conocimientos sobre todo esto, repito, superan hoy ampliamente a los que pudiera haber intuido el más lúcido de nuestros antepasados.
Antes, empero, de que imitando la
acción de la bomba de hidrógeno nos proyectemos más allá de la
atmósfera, ampliemos nuestras afirmaciones y establezcamos unos
cuantos hechos.
Supone más de las tres cuartas partes de la masa total de la atmósfera. Ostenta una peculiaridad inesperada e interesante, de la que carecen los demás estratos atmosféricos: está dividida en dos partes, estableciéndose la línea divisoria entre ambas cerca del Ecuador. El aire de cada región no se mezcla libremente con el aire de la otra, como cualquiera que haya viajado en barco por regiones tropicales puede atestiguar; existe una nítida diferencia entre la claridad de los cielos meridionales y la relativa turbiedad de los septentrionales.
Hasta hace muy poco era opinión general que los gases de la troposfera reaccionaban muy levemente entre ellos, salvo quizás durante el intenso calor generado por descargas eléctricas o fenómenos equivalentes. Hoy, gracias a las investigaciones pioneras que en materia de química atmosférica han realizado sir David Bates, Christian Junge y Marcel Nicolet, sabemos que los gases de la troposfera reaccionan con la intensidad de una llama fría de tamaño planetario y combustión lenta.
Muchos de ellos se combinan con el
oxígeno, desapareciendo como gases libres; tales reacciones son
posibles en virtud de la energía solar que, mediante una compleja
secuencia de acontecimientos, transforma las moléculas de oxígeno en
compuestos de otro tipo —ozono, radicales hidróxilos y demás—;
éstos, además de vehicularlos eficazmente, tienen más reactividad
que él.
La temperatura es sumamente baja en su límite inferior, la denominada tropopausa, pero asciende según nos desplazamos hacia arriba. La naturaleza de los dos estratos hasta ahora atravesados por nuestro astronauta está íntimamente asociada con los gradientes de temperatura detectables en el interior de cada uno. En la troposfera, donde por cada centenar de metros de ascenso la temperatura desciende aproximadamente 1° C, es fácil el movimiento vertical del aire y la regla la formación de nubes.
En la estratosfera, donde la temperatura se incrementa con la altitud, el aire caliente muestra resistencia a subir, siendo norma, por tanto, la estabilidad estratificada. A la radiación solar ultravioleta más dura y poderosa corresponde la fragmentación de las moléculas de oxígeno en sus átomos constituyentes, aunque suelen tardar poco en recombinarse de nuevo, a menudo en forma de ozono. Este sufre también la acción separadora de los rayos ultravioletas, estableciéndose el equilibrio con una densidad máxima de ozono de cinco partes por millón.
El aire de la estratosfera no es mucho más denso que el de Marte: no existe forma de vida de respiración aérea que pueda sobrevivir en ella. Si se utilizara un entorno presurizado para solventar el problema de la baja presión no habría forma de vida que pudiera resistir el envenenamiento por ozono.
Como las
tripulaciones y pasajeros de ciertas aeronaves que sirven trayectos
largos y vuelan a gran
altura han descubierto recientemente con riesgo para su salud y
sensaciones muy desagradables, al aire estratosférico no puede
respirarse aunque se le proporcione la temperatura y la presión
adecuadas antes de hacerlo pasar el interior de la cabina. El smog,
por comparación, resulta bastante más saludable.
Esta especialidad tiene hasta una designación específica, aeronomía química, acuñada por Sidney Chapman, uno de sus más cualificados representantes. Y sin embargo, salvo por las repercusiones —aducidas, pero no probadas— de los cambios en la concentración de ozono, la relación entre la biosfera y las capas superiores de la atmósfera parece tener menos entidad que la establecida por los científicos que las convierten en su objeto de estudio. Si hago esta puntualización no es por afán crítico, sino para dejar constancia de que la ciencia tiende a concentrarse en lo que puede medirse y discutirse.
A consecuencia de esta actitud, la troposfera, que es la parte más voluminosa de la atmósfera y ciertamente la de mayor relevancia para Gaia, se conoce bastante menos. Por encima de la estratosfera está la ionosfera, donde la rarificación del aire es muy intensa; el ritmo de las reacciones químicas es también más vivo en razón de lo tenue del filtro que se interpone en el camino de los rayos solares. En estas regiones, la mayoría de las moléculas, no sólo el nitrógeno y el CO2, son escindidas en los átomos que las constituyen.
Algunos de éstos sufren ulterior fragmentación,
convirtiéndose en iones positivos y electrones; ello da lugar a la
formación de estratos eléctricamente conductores que, en la época
anterior a los satélites de comunicaciones fabricados por el hombre,
eran importantes por su capacidad para reflejar las ondas de radio,
permitiendo la comunicación entre puntos alejados del planeta.
Hoy, sin embargo, nos parece
dudoso que este proceso tenga lugar a escala suficiente para
repercutir en la cantidad de oxígeno; parece, además, que el flujo
de átomos de hidrógeno procedente del Sol compensa o supera incluso
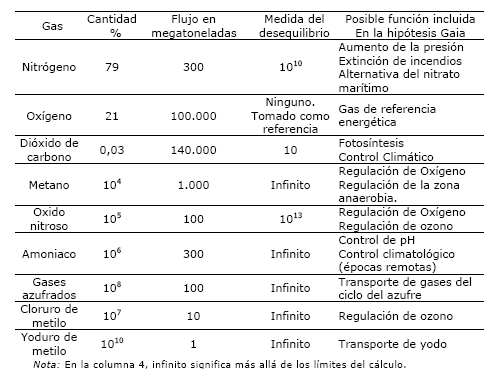
los que escapan de la exosfera. La Tabla 3 recoge los principales
gases reactivos del aire, sus concentraciones, sus tiempos de
permanencia y sus fuentes más importantes.
Aparecían por todas partes transgresiones a las normas del equilibrio químico y, sin embargo, en el seno de este desorden aparente se mantenían constantes, de alguna forma, unas condiciones favorables para la vida. Cuando acaece lo inesperado y no puede achacarse a la casualidad, lo procedente es buscar una explicación racional.
Veamos, pues, si la hipótesis de la existencia de Gaia nos sirve para explicar la extraña composición de nuestra atmósfera, dado que según ella es la biosfera la que mantiene y controla activamente el aire dentro del cual vivimos, suministrando de tal modo un entorno óptimo para la vida del planeta.
Para confirmar o
negar este supuesto examinaremos la atmósfera de modo muy parecido a
cómo el fisiólogo estudia los componentes de la sangre, cuando lo
hace preguntándose de qué forma contribuye cada uno de ellos a
mantener viva la criatura de la que proceden. Tabla 3.
Algunos gases químicamente reactivos del aire. Desde el punto de vista químico, aunque no en términos de abundancia, el gas dominante en el aire es el oxígeno. Es este elemento el que establece el nivel referencial de energía química a todo lo largo y ancho del planeta, nivel que hace posible encender fuego —dada una substancia combustible— en cualquier punto de la Tierra.
Ofrece una diferencia de potencial químico lo bastante amplia para que los pájaros puedan volar y nosotros podamos correr y mantener nuestra temperatura cuando la exterior desciende; quizá, incluso, hasta pensar. El nivel actual de la tensión de oxígeno representa para la biosfera contemporánea lo mismo que el suministro de electricidad de alto voltaje para nuestra sociedad de hoy. Las cosas pueden continuar sin electricidad, pero las potencialidades menguan substancialmente. La comparación es bastante exacta, porque en química, el poder oxidante de un entorno se expresa, por convenio, en términos de su potencial redox (potencial de oxidación-reducción), medido eléctricamente y cuya unidad es el voltio.
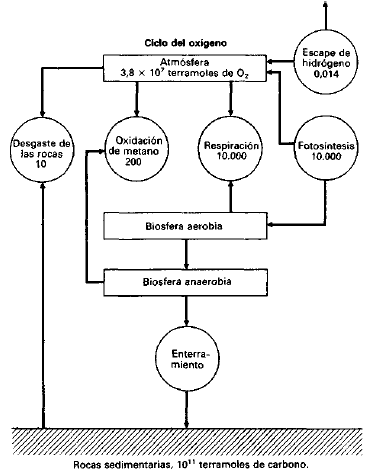
El potencial redox mediría en realidad el voltaje de una hipotética pila que tiene uno de sus polos conectado al oxígeno y el otro a las substancias nutritivas. Casi todo el oxígeno que genera la fotosíntesis de las plantas verdes se introduce en la atmósfera para ser utilizado en esa otra actividad fundamental de la vida, la respiración, en un lapso de tiempo relativamente corto.
Este proceso complementario, la respiración, jamás resultará, obviamente, en un aumento neto del oxígeno: ¿cómo se ha acumulado entonces este gas en la atmósfera?
Hasta fecha reciente se pensaba que la fuente principal era la fotolisis del vapor de agua en las capas superiores: las moléculas de agua escindidas liberan átomos de hidrógeno lo bastante ligeros para escapar al campo gravitatorio terrestre y átomos de oxígeno que se unen de dos en dos para formar moléculas de dicho gas o de tres en tres para dar moléculas de ozono.
Cierto es que este proceso produce un incremento neto del oxígeno pero, por muy importante que pudiera ser éste en el pasado, en la biosfera contemporánea es una fuente desdeñable. Parece haber pocas dudas sobre la identidad de la fuente principal del oxígeno atmosférico; a Rubey corresponde el honor de haber sido el primero en establecerla (1951). Las rocas sedimentarias contienen una pequeña proporción del carbono que los vegetales habían fijado en la materia orgánica de sus tejidos.
Aproximadamente el 0,1 por ciento del carbono fijado anualmente es
enterrado con los restos vegetales que, procedentes de las masas
terrestres, terminan en los cursos fluviales o en los mares. Cada
átomo de carbono que de tal forma es extraído del ciclo fotosíntesis-respiración significa una molécula más de oxígeno en el
aire. Si no fuera por este proceso, el oxígeno desaparecería
gradualmente de la atmósfera al ir reaccionando con las substancias
reductoras que la climatología, los terremotos y los volcanes hacen
llegar a la superficie.
Esta suposición ha sido popular durante mucho tiempo pero, como indicábamos en el capítulo 2, se cree actualmente que incluso los primeros organismos fotosintetizadores disponían de un potencial químico tan alto como el utilizado por los microorganismos actuales. En los primeros tiempos, el amplio gradiente de energía potencial actualmente suministrado por el oxígeno estaba disponible tan sólo en el espacio intracelular de los citados microorganismos.
Después, según se multiplicaban, se amplió a su microambiente y continuó extendiéndose más y más, marchando al mismo paso que la vida, hasta que se completó la oxidación de las substancias reductoras primigenias y el oxígeno pudo por fin aparecer en el aire.
Desde el principio, sin embargo, la diferencia de energía potencial entre los oxidantes de las células de los fotosintetizadores y el ambiente reductor externo era tan grande como la que hoy existe entre el oxígeno extracelular y los nutrientes intracelulares.
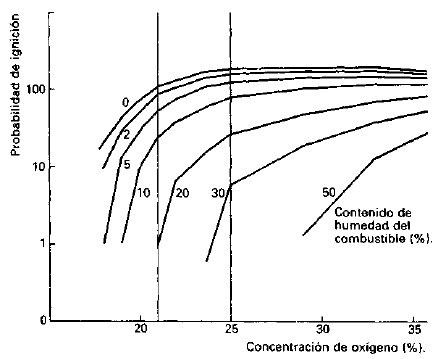
Las fuentes de potenciales altos, ya sean eléctricos o químicos, son peligrosas, y el oxígeno conlleva riesgos especiales. Nuestra atmósfera actual, cuyo nivel de oxígeno es del 21 por ciento, se halla en el límite superior del intervalo seguro para la vida. Por poco que aumentara esta cifra el peligro de incendio crecería vertiginosamente. La probabilidad de incendio forestal a consecuencia de la caída de rayos subiría un 70 por ciento por cada 1 por ciento de aumento del presente nivel.
Si éste sobrepasara el 25 por ciento, muy poca vegetación sobreviviría a los devastadores incendios, que arrasarían tanto la pluvisilvía tropical como la tundra ártica. Andrew Watson, de la Universidad de Reading, ha confirmado experimentalmente estos supuestos, estableciendo la probabilidad de incendio para diferentes concentraciones de oxígeno en unas condiciones muy semejantes a las existentes en las auténticas selvas. El diagrama adjunto (fig. 5) muestra los resultados.
El actual nivel de oxígeno está en un punto donde el riesgo y el beneficio se equilibran confortablemente. Claro que estallan fuegos forestales, pero sin que su frecuencia sea tan elevada como para estorbar la alta productividad que un nivel de oxígeno del 21 por ciento permite, y de nuevo nos hallamos ante una situación superponible a la del suministro eléctrico: si aumentamos el voltaje, la cantidad de energía disipada en el transporte y el cobre necesario para los cables disminuyen enormemente, pero por encima de los 250 voltios el peligro de incendio y de muerte por shock aumentaría de tal modo que las ventajas antedichas no serían justificables.
Los ingenieros de una central eléctrica no
permitirían jamás
que su equipo funcionara al buen tuntún; está diseñado para un
funcionamiento preciso, para garantizar un suministro constante de
energía
eléctrica segura. ¿Cómo se controla entonces el nivel de oxígeno del
aire?
Empecemos por el metano.
Aunque no negaremos la importancia de esta contribución, sabemos actualmente que el origen de la fracción capital de este gas es la fermentación bacteriana de los fangos y sedimentos depositados en lechos marinos, ciénagas, terrenos anegados y estuarios fluviales, lugares todos donde tiene lugar enterramiento de carbono. La cantidad de metano producida de esta forma es asombrosamente grande: por lo menos 1.000 millones de toneladas anuales.
(El gas
"natural" bombeado al interior de nuestros hogares es de estirpe
bien distinta; se trata de gas fósil, del equivalente gaseoso del
carbón y el petróleo. Presente en cantidades triviales a escala
planetaria, sus pequeñas reservas se habrán agotado dentro de unos
diez años.)
Las incesantes burbujas de metano que ascienden hacia la superficie de los barros fétidos las limpian de substancias volátiles venenosas (los compuestos metílicos de arsénico y plomo, por ejemplo), además de librarlas del oxígeno, elemento venenoso para los microorganismos anaerobios. Cuando el metano alcanza la atmósfera, se comporta como un regulador bidireccional de oxígeno, capaz de retener a un nivel y de devolver a otro.
Parte llega a la estratosfera antes de que la oxidación lo convierta en dióxido carbónico y vapor de agua; es la fuente principal de éste en las capas altas de la atmósfera. El agua termina por disociarse en oxígeno, que desciende, e hidrógeno, que escapa al espacio. Este proceso asegura, a largo plazo, un pequeño incremento del oxígeno (pequeño pero posiblemente significativo).
Si
la situación está equilibrada, el escape de hidrógeno siempre
significa una ganancia neta de oxígeno.
Un sencillo cálculo aritmético nos indica que, en
ausencia de metano, la concentración de oxígeno crecería un 1 por
ciento en 12.000 años, cantidad excesiva para tan pequeño lapso de
tiempo: un cambio peligroso y, en la escala temporal geológica,
demasiado rápido.
La biosfera es, sin embargo, una máquina demasiado poderosa para dejar el control de su funcionamiento a cargo únicamente de lo que los ingenieros llaman un sistema de control pasivo, como si en la central eléctrica la presión de la caldera estuviera determinada por el equilibrio entre la cantidad de fuel quemado y la cantidad de vapor necesaria para mover las turbinas. Cuando la demanda descendiera —en los domingos soleados, por ejemplo— la presión aumentaría hasta poner a la caldera en peligro de explosión y, en los períodos de máxima demanda, la presión caería en picado, siendo imposible suministrar la energía pedida.
Por este motivo, los
ingenieros utilizan sistemas de control activo que, como
explicábamos en el capítulo 4, incorporan sensores. En el caso de la
central, el sensor de presión o temperatura registraría cualquier
desviación respecto a las condiciones óptimas empleando una pequeña
cantidad de la energía del sistema para modificar el ritmo de
quemado del combustible.
En la actualidad, la cantidad de carbono utilizado para producir esa cifra anual de 1.000 megatoneladas es veinte veces superior al carbono enterrado. De ello se desprende que cualquier mecanismo capaz de modificar esta proporción será un eficaz regulador del oxígeno.
Quizá, cuando la tasa de oxígeno atmosférico se hace excesiva, se genere algún tipo de señal que desencadene una mayor producción de metano; el paso de este gas regulador a la atmósfera pronto restablecería el amenazado equilibrio.
Vemos, pues, cómo la energía aparentemente derrochada en la oxidación de metano es el precio inevitable de un regulador activo, constante y de acción rápida.
No deja de ser curioso pensar que, sin
el auxilio de la microflora anaerobia cuya morada está en los
malolientes barros de lechos marinos, lagos y estanques, quizá no
existieran ni escritores, ni lectores, ni libros, porque sin el
metano por ella generado la concentración de oxígeno ascendería
inexorablemente hasta un nivel en el que todo incendio cobraría
proporciones desmesuradas, haciendo imposible cualquier otra forma
de vida diferente a la microflora de los terrenos pantanosos.
Si hay abundancia de nitrógeno y escasez
de óxido nitroso se debe a que el primero es un gas muy estable y se
acumula, mientras el óxido nitroso es destruido rápidamente por la
radiación ultravioleta del Sol.
El volumen de oxígeno que desde el
suelo y los lechos marinos transporta el óxido nitroso es dos veces
la cantidad necesaria para equilibrar las pérdidas producidas por la
oxidación de las materias reductoras llegadas constantemente a la
superficie de la Tierra desde su interior. Podría actuar, por lo
tanto, como contrapeso del metano. Es por lo menos verosímil que la
producción de uno y otro sean complementarias; ambas podrían ser
reguladores rápidos de la concentración de oxígeno.
De hecho, si los óxidos de nitrógeno destruyen el ozono, la naturaleza agrede a la antedicha capa desde hace mucho, pero que mucho tiempo. Un exceso de ozono sería tan malo como carecer de él; el ozono, del mismo modo que los demás componentes de la atmósfera, tiene también un óptimo deseable. Si se incrementara en cuantía superior al 15 por ciento se producirían repercusiones negativas en el clima.
Sabemos además, con toda certeza, que la radiación ultravioleta tiene aspectos útiles y beneficiosos, y una capa de ozono más densa podría impedir su llegada a la Tierra en dosis suficientes.
En los seres humanos, la vitamina D se forma en la piel a resultas de la acción ejercida sobre ella por los rayos ultravioletas. Si una radiación ultravioleta excesiva puede favorecer el cáncer de piel, su debilitamiento producirá raquitismo con toda seguridad. Aunque la producción de óxido nitroso por parte de los indicados microorganismos no nos beneficie directamente, la radiación ultravioleta de bajo nivel podría ser de importancia para otras especies en procesos aún por descubrir.
Como regulador al
menos —junto a otro gas atmosférico de origen biológico
recientemente descubierto, el cloruro de metilo— podría ser valioso.
El sistema de control de Gaia incluiría también un medio para
detectar la cantidad de ultravioleta filtrada a través de la capa de
ozono, regulándose subsiguientemente la producción de óxido nitroso.
Teniendo en cuenta los ácidos que la oxidación del nitrógeno y el azufre producen, el amoníaco generado por la biosfera es justamente el necesario para mantener alrededor de 8 el pH de la lluvia, cifra óptima para la vida. De faltar el amoníaco, este pH caería hasta un valor de 3, acidez comparable a la del vinagre; esto ya sucede en ciertas partes de Escandinavia y de Norteamérica, con efectos desastrosos para el desarrollo vegetal.
La
causa de este fenómeno serían los humos desprendidos por la
combustión de los combustibles industriales y domésticos en áreas
densamente pobladas: la mayoría de estos combustibles contienen
azufre que, expelido a la atmósfera, vuelve al suelo con la lluvia
en forma de ácido sulfúrico.
En primer lugar, la estabilidad del clima quizá requiera la actual densidad atmosférica y el nitrógeno resulta conveniente para incrementar la presión.
En segundo, un gas de reactividad escasa como el nitrógeno es lo más adecuado para diluir el oxígeno del aire; como hemos visto en páginas anteriores, una atmósfera de oxígeno puro tendría consecuencias desastrosas.
En tercer lugar, si la totalidad del nitrógeno estuviera en los mares como ion nitrato, el siempre delicado problema de mantener la salinidad lo bastante baja para permitir la vida, empeoraría. Como veremos en el capítulo siguiente, la membrana celular es extremadamente vulnerable a la salinidad de su entorno; una salinidad total por encima de 0,8 molar la destruye, con independencia de que se trate de cloruro, de nitrato o de una mezcla de ambos.
Si todo el nitrato estuviera en
los mares como ion nitrato, la molaridad pasaría de 0,6 a 0,8: ello
significaría la incompatibilidad del agua marina con casi todas las
formas conocidas de vida. Señalemos finalmente que además de su
efecto sobre la salinidad marina, las concentraciones altas de
nitrato son venenosas. La adaptación a un entorno con fuerte
contenido de nitratos habría sido más difícil y más onerosa
energéticamente para la biosfera que el simple almacenamiento del
nitrógeno en la atmósfera, donde además resulta de cierta utilidad.
Cualquiera de las posibilidades expuestas podría, pues, constituir
un motivo válido para justificar la existencia de los procesos
biológicos que transportan nitrógeno desde la superficie a la
atmósfera.
Uno es el radical
metilo, primer producto de la oxidación del metano. Unos
1.000 millones de toneladas pasan anualmente por la atmósfera,
aunque en razón de su cortísima vida —menos de un segundo— no suele
haber más de uno por centímetro cúbico de aire. No es éste el lugar
apropiado
para describir detalladamente la compleja química de tales
substancias, pero resultan interesantes para quienes quieran saber
algo más de los gases atmosféricos.
El gas más abundante de
este grupo es el argón que, con el helio y el neón, supone casi el 1
por ciento de la atmósfera, lo que parece en contradicción con el
remoquete de raro. Estos gases inertes son de inequívoco origen
inorgánico y resultan de utilidad para establecer con mayor claridad
el inerte telón de fondo contra el que destaca la vida.
Nuestro
persistente y autoimpuesto apartamiento de la naturaleza suele
hacernos pensar que los productos industriales están en las
antípodas mismas de lo "natural": en realidad, habida cuenta de que
son el resultado de la actividad de un grupo de seres vivos, la
especie humana, resultan a la postre tan naturales como todos los
demás compuestos químicos de la Tierra. Obviamente en ocasiones son
productos agresivos, peligrosos o incluso letales, como los gases
nerviosos, pero ninguno de ellos supera en toxicidad a la toxina
fabricada por el bacilo botulinus.
Suponiendo que mañana interrumpiéramos el consumo de estos combustibles, no haría falta mucho tiempo (quizá unos treinta años) para que este incremento desapareciera, restableciéndose el equilibrio entre la cantidad de gas del aire y de bicarbonato en el mar. A consecuencia del quemado de combustibles fósiles, el CO2 del aire ha aumentado aproximadamente un 12 por ciento.
En el capítulo 7
se examinan las consecuencias de esta modificación causada por el
hombre.
Siendo así las cosas, ¿se necesita la intervención de Gaia?
La respuesta es
que podría ser muy necesaria si los ajustes no se realizan con la
celeridad suficiente para el conjunto de la biosfera. Es algo
parecido a la situación de quien una mañana invernal no puede salir
de casa porque la nieve bloquea la puerta. Sabe, naturalmente, que
el obstáculo terminaría por desaparecer espontáneamente, pero ello
no le impide apresurarse a retirarlo.
El CO2 no es sólo fuente de carbono para la fotosíntesis; son muchos también los organismos heterotróficos (es decir, no fotosintéticos) que lo captan de la biosfera y lo convierten en materia orgánica. Hasta los animales —cuya respiración es, desde luego fuente de CO2— incorporan a sus organismos pequeñas cantidades de este gas atmosférico.
En realidad, cuanto mayor parece
ser la importancia de los procesos del equilibrio inorgánico en la
determinación de la cuantía atmosférica de un gas, mayor puede ser
su interacción con la biosfera, y ello no es de extrañar si se
piensa que ésta controla activamente su entorno y utiliza las
condiciones dadas en su propio beneficio.
La luz del Sol puede evaporar
agua de los mares, agua cuyo destino es precipitarse sobre la
tierra, pero lo que la luz solar no hace espontáneamente en la
superficie de la Tierra es separar el oxígeno del agua ni establecer
las reacciones que determinan la síntesis de substancias y
estructuras complejas.
De igual modo que el CO2, el vapor de agua tiene las propiedades de un gas invernadero e interactúa intensamente con la biosfera.
Si
aceptamos la proposición de que la vida controla y adapta
activamente el entorno atmosférico según sus necesidades, su
relación con el vapor de agua ilustra nuestra conclusión de que las
incompatibilidades de los ciclos biológicos y el equilibrio
inorgánico son más aparentes que reales.
|